相关数据显示,自2007年开始,隆胸手术就一直占据美国美容手术的首位,也是全球医美行业的标杆项目之一。然而近几个月来,随着一种罕见病BIA-ALCL被大众媒体所关注,关于乳房假体安全性的讨论越来越热,不乏以讹传讹。市场开始质疑乳房假体,特别是在欧洲和亚洲占据主流的毛面假体的安全性。不少求美者因而观望或退缩——从法国开始的怀疑论让全球隆胸行业都仿佛进入渐冻期。
今年3月,美国食品药品监督局FDA召开了一场关于乳房假体的公共咨询委员会会议,广泛听取来自公众、科学专业人士、医学专业人士、患者群体代表和其他利益相关者的深刻见解和个人建议,并于会上讨论了一系列有关乳房假体安全性的重要议题。
可以说从去年以来,各国监管机构、执业医师和生产企业都在翘首期待FDA对于毛面乳房假体的最终结论。作为全世界公认的最权威的监管机构,美国FDA对乳房假体安全性的规范最为科学和严格,其给出的指导性建议通常被认为是全球隆胸行业参照的标准。
5月2日,权威消息终于确定。一锤定音!FDA认可毛面乳房假体临床使用!
FDA为何对毛面假体采取认可态度?理由是FDA认为市场监管行为必须基于科学的临床数据。
首先,基于目前所有可用的数据和信息,毛面乳房假体没有触及到《联邦食品、药品和化妆品法案》中规定的禁用标准。
其次,FDA认为,虽然大多数BIA-ALCL患者都使用了毛面假体,但也有在植入光面乳房假体患者中患BIA-ALCL的病例;并且许多报告中其实并未列明诊断时所使用假体的表面情况。
FDA介绍,作为美国卫生及公共服务部一个致力于保护公众健康的机构,当前重点工作一是在于进一步加强数据收集从而帮助FDA做出最合理的科学监管决策;二是要做出更多努力来保护考虑植入乳房假体的女性。FDA目前也正在研究帮助女性能获得更多乳房假体信息的方法,从而做出知情决定。
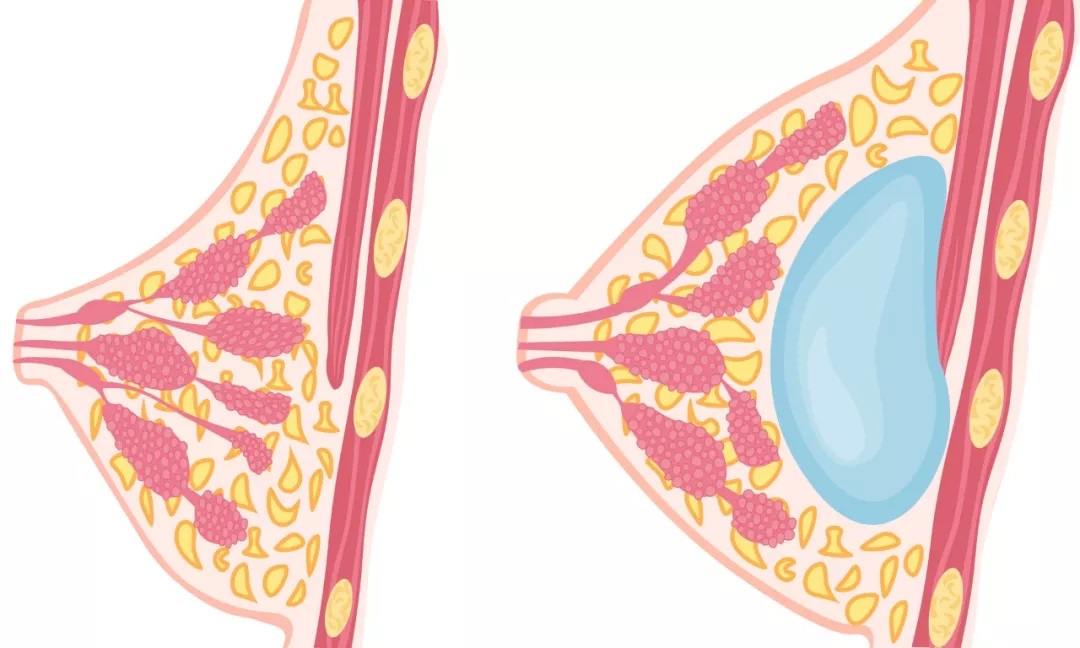
最终,5月2日,FDA也随即向公众宣布了几项已实施的新措施:
1、FDA正在研究如何将产品成分信息以一种患者容易理解的方式体现于标签上。FDA介绍,医美机构将与包括患者群体在内的利益相关者,就FDA提出或建议的任何标签内容和格式(包括黑框警告和患者决策清单)的变更进行合作;FDA也将与制造商合作,对其提供给医疗保健专业人员和患者的信息(包括标签)进行变更。
2、FDA致力于使医疗器械报告更加透明。相信这将有助于提高女性对植入乳房假体不良反应的认知。FDA介绍,在未来,乳房假体制造商将被要求提交单独的医疗器械报告,这些报告将在MAUDE公开发布,方便公众查询。
3、FDA将与注册部门合作,帮助其评估生产商关于乳房患者的数据。FDA认为,这将有助于改善乳房假体证据收集的情况,并可以极大地促进FDA对于BIA-ALCL的系统理解和进一步评估。
FDA相信,上述改善沟通行为和强化数据收集的举措将对提高乳房假体的安全性做出重大贡献。未来,FDA将继续致力于改善女性健康,并将继续努力确保FDA了解乳房假体的益处和风险,以确保女性获得最完整的信息来做出乳房假体植入的知情选择。
未经允许不得转载:医美视界 » 一锤定音!FDA认可毛面乳房假体临床使用


 医美视界
医美视界
 第九届中国抗衰老医学大会暨抗衰老产品博览会总议程
第九届中国抗衰老医学大会暨抗衰老产品博览会总议程 近5万次扫码验真 “一物一码可溯源”助力放心变美
近5万次扫码验真 “一物一码可溯源”助力放心变美 第五届衡力·中国整形美容协会科学技术奖·颁奖大会
第五届衡力·中国整形美容协会科学技术奖·颁奖大会 IAIC杭州国际医美产业大会圆满落幕
IAIC杭州国际医美产业大会圆满落幕
